基础电子学 - 材料
物质由分子组成,分子由原子组成。根据玻尔理论,"原子由带正电的原子核和一些带负电的电子组成,这些电子以不同的轨道围绕原子核旋转"。当电子从较低状态升至较高状态时,它被称为激发。在激发状态下,如果电子完全脱离原子核,则原子被称为电离。因此,将原子从正常状态提升到电离状态的过程称为电离。
下图显示了原子的结构。
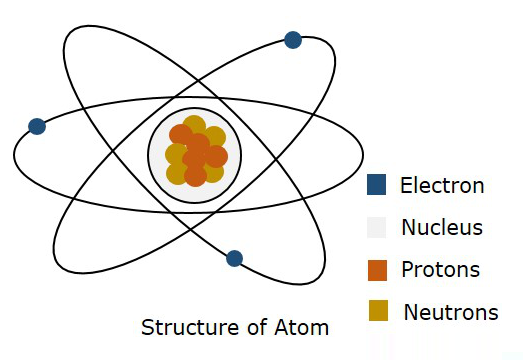
根据玻尔模型,电子在特定的轨道中移动,而根据量子力学,电子位于原子的自由空间中的某个位置,称为轨道。量子力学的这一理论被证明是正确的。因此,可能找到电子的三维边界称为原子轨道。
量子数
电子移动的每个轨道的能量和形状都不同。轨道的能级可以用离散的积分和半积分集(称为量子数)来表示。有四个量子数用于定义波函数。
主量子数
描述电子的第一个量子数是主量子数。它的符号是n。它指定数字的大小或顺序(能级)。随着n值的增加,电子到原子核的平均距离也增加,同时,电子的能量也增加。主能级可以理解为壳层。
角动量量子数
这个量子数的符号是l。这个l表示轨道的形状。其范围从 0 到 n-1。
l = 0, 1, 2 …n-1
对于第一个壳层,n = 1。
即,对于 n-1,当 n = 1 时,l = 0 是 l 的唯一可能值。
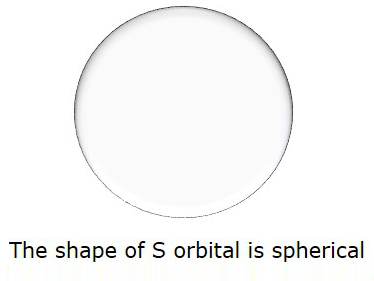
因此,当 l = 0 时,它被称为 S 轨道。S 的形状为球形。下图表示 S 的形状。
如果 n = 2,则 l = 0、1,因为这是 n = 2 的两个可能值。
我们知道 l = 0 时是 S 轨道,但如果 l = 1,则是 P 轨道。
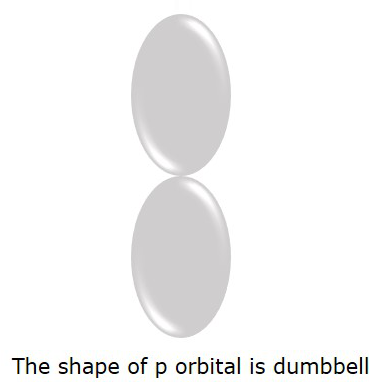
电子更可能找到的 P 轨道呈 哑铃 形状。如下图所示。
磁量子数
该量子数用 ml 表示,表示轨道围绕原子核的方向。 ml 的值取决于 l。
$$m_{l}= \int (-l\:\:to\:+l)$$
对于 l = 0,ml = 0,这代表 S 轨道。
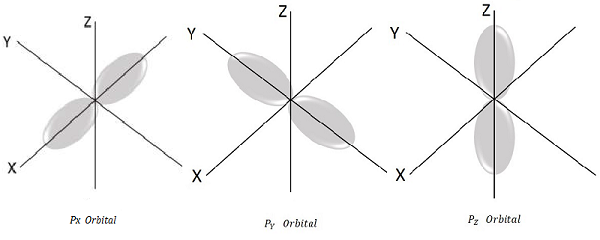
对于 l = 1,ml = -1、0、+1,这是三个可能的值,这代表 P 轨道。
因此,我们有三个 P 轨道,如下图所示。
自旋量子数
这由 ms 表示,这里的电子在轴上旋转。电子自旋的运动可以是顺时针的,也可以是逆时针的,如下图所示。
这个自旋量子数的可能值如下,
$$m_{s}= +\frac{1}{2}\:\:up$$
对于称为自旋向上的运动,结果为正半部分。
$$m_{s}= -\frac{1}{2}\:\:down$$
对于称为自旋向下的运动,结果为负半部分。
这是四个量子数。
泡利不相容原理
根据泡利不相容原理,原子中没有两个电子可以具有相同的四个相同量子数集。这意味着,如果任何两个电子具有相同的 n、s、ml 值(正如我们上面讨论的那样),那么它们的 l 值肯定会不同。因此,没有两个电子会具有相同的能量。
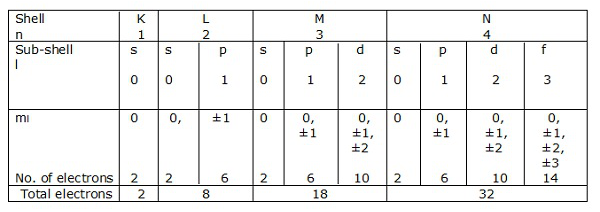
电子壳层
如果 n = 1 是壳层,则 l = 0 是子壳层。
同样,n = 2 是壳层,l = 0,1 是子壳层。
对应于 n = 1、2、3….. 的电子壳层分别用 K、L、M、N 表示。对应于 l = 0、1、2、3 等的子壳层或轨道分别用 s、p、d、f 等表示。
让我们来看看碳、硅和锗(IV 族 - A)的电子结构。

观察到,每种情况下最外层的 p 子壳层仅包含两个电子。但可能的电子数量为六个。因此,每个最外层壳层中有四个 价电子。因此,原子中的每个电子都具有特定的能量。任何类型物质分子内的原子排列几乎都是这样的。但原子之间的间距因材料而异。

